2020年09月03日,国家药品监督管理局医疗器械技术审评中心发布《超声软组织切割止血系统同品种临床评价技术审查指导原则(征求意见稿)》,旨在进一步规范超声软组织切割止血系统的同品种临床评价。为了更好的帮助您快速了解全文,小编已梳理出重点内容,供您阅览!
敲黑板,划重点
1、适用范围
► 本原则基于《医疗器械临床评价技术指导原则》并结合超声软组织切割止血系统的特点制定。
► 适用于超声软组织切割止血系统的同品种临床评价工作。
二、基本原则
► 注册申请人需按国家有关文件的导则要求进行临床评价。
► 注册申请人需本着科学、客观的原则,根据申报产品实际情况确定临床评价路径,提供相应的临床评价资料。
► 若注册申请人通过同品种的方式开展临床评价,针对拟申报产品和同品种产品之间的差异,需提供相应的支持性资料评价差异性对申报产品的安全有效性是否产生不利影响,如体外爆破压力实验和动物实验。
三、同品种临床评价
► 同品种对比要求
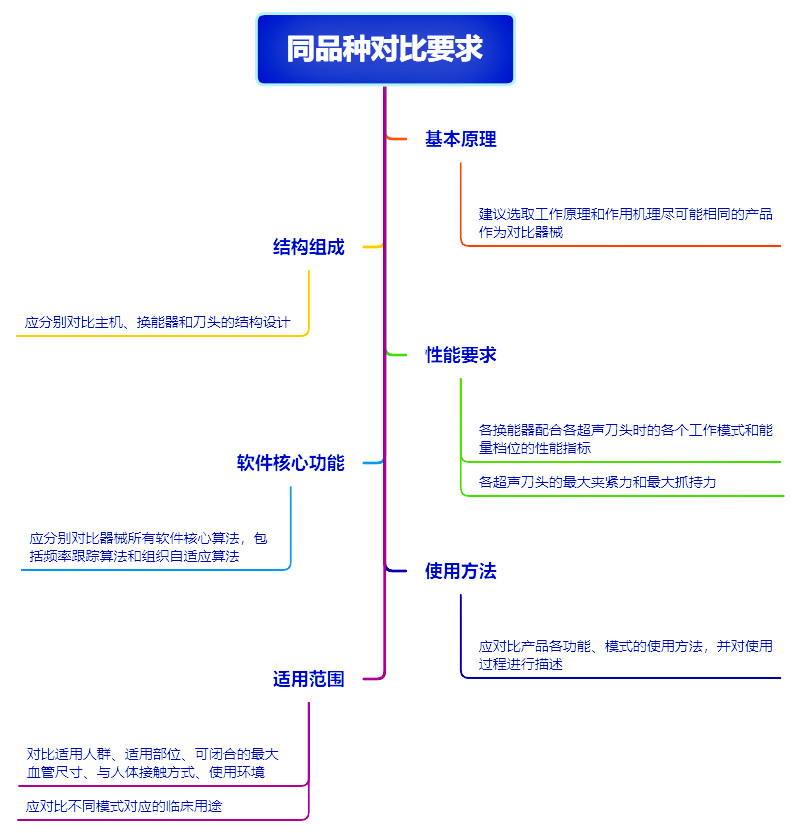
►基本等同性判定
基于申报产品与对比器械的同品种比对,申报产品与对比器械的基本等同性判定还需结合台架实验和/或动物实验数据进行分析。非临床试验数据包括但不限于:体外爆破压实验、急性动物实验和慢性动物实验,实验要求见下图。
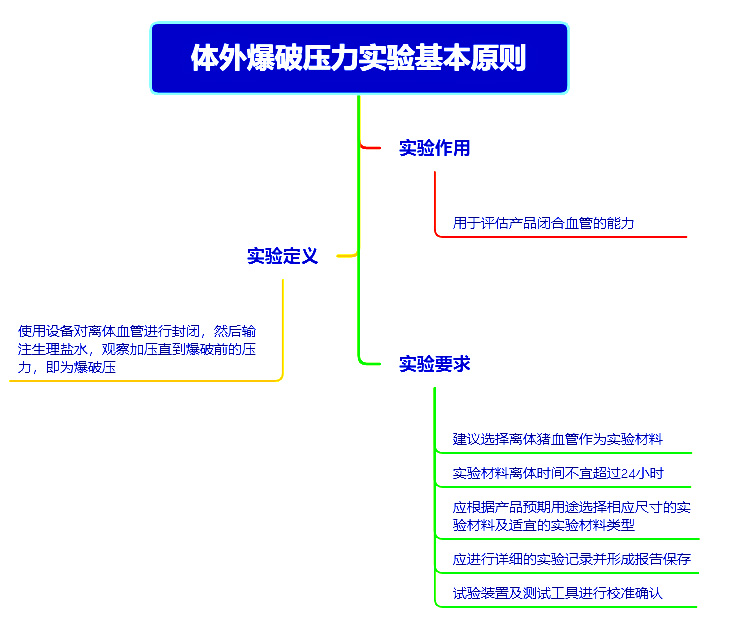
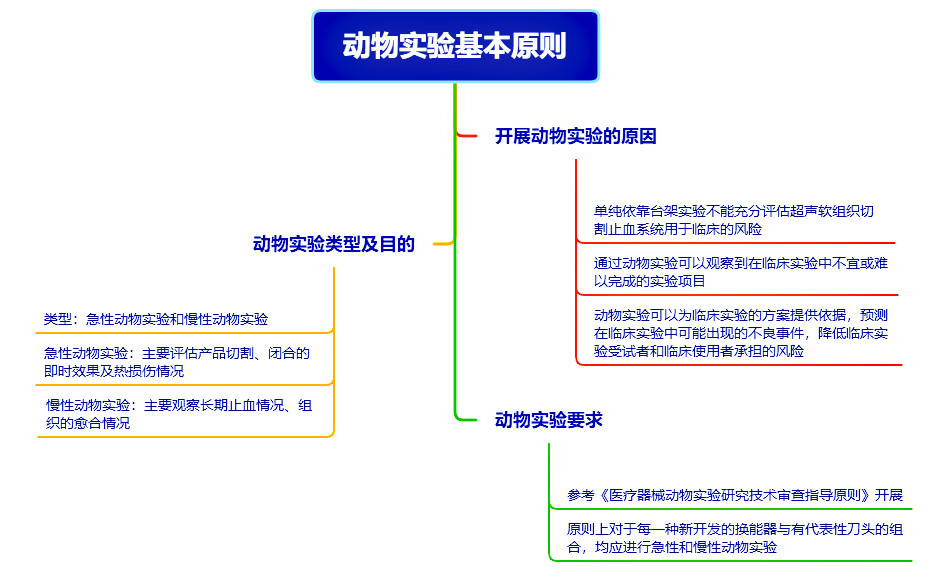
►同品种医疗器械临床数据分析评价
原文链接:https://www.cmde.org.cn/CL0004/21581.html
【原文来源】国家药品监督管理局医疗器械技术审评中心
【全文整理】苏州大学卫生与环境技术研究所
【声明】如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注。