答:建议参考GB/T 16886.1标准要求,至少包括细胞毒性、致敏反应、刺激或皮内反应、材料介导的致热性、急性全身毒性、亚急性毒性、亚慢性毒性、慢性毒性、植入反应、血液相容性、遗传毒性、致癌性(如适用)。
审评五部
答:目前我国尚无专门针对单间室膝关节假体的磨损试验方法的国家标准或行业标准,申请人可参考全膝关节假体磨损试验方法的国际标准,如ISO 14243-1或ISO 14243-3、ISO 14243-2等标准。建议结合单间室膝关节假体与全膝关节假体在临床使用情况上的差异进行合理调整和优化,对单间室膝关节假体磨损性能的可接受性进行合理性论述。
审评四部
答:由于实验用动物的解剖结构限制,导管三尖瓣置换器械成品可能无法进行原位植入的动物试验,可以选择相同生产工艺生产的等比例缩小的试样或选择合适的动物模型进行动物试验。如使用等比例缩小的试样,需提供试样合理性分析,分析尺寸差异对试验结果的影响。
审评三部
问:包含双极头组件的髋关节系统类产品,其适用范围应如何规定?
答: 对于包含双极头组件的髋关节系统类产品,建议适用范围规定为“该产品作为骨水泥型/非骨水泥型髋关节假体,适用于全髋关节置换。双极头用于半髋关节置换。”
审评四部
答:建议按照需氧菌菌落总数、霉菌和酵母菌总数分别制订负载量,并将金黄色葡萄球菌、铜绿假单胞菌和白色念珠菌列为控制菌,不得检出。
审评五部
问:按照“免于进行临床评价”路径申报的产品,增加“同品种比对”路径的临床评价资料是否可行?
答:对于按照“免于进行临床评价”路径申报的产品,针对属于《免于临床评价医疗器械目录》所述内容范围的型号规格,按照《列入免于进行临床评价医疗器械目录产品对比说明技术指导原则》的要求提交资料;针对超出《免于临床评价医疗器械目录》所述内容范围的型号规格,允许申请人提交超出范围的产品临床评价资料。
审评四部
问:经导管三尖瓣置换器械如何制定戊二醛残留指标?
答:戊二醛残留是指经导管三尖瓣置换器械在按照说明书推荐的清洗方法清洗后瓣膜上残留的戊二醛含量。申请人可根据已知人体允许限量和产品质量控制要求合理制定戊二醛残留量指标,方法建立可参照GB/T 16886.17推荐的医疗器械可沥滤物允许限量进行。其他相类似的生物瓣膜类产品的戊二醛残留指标也可参考此方法制定。
审评三部
问:持续葡萄糖监测系统在原有成人适用范围的基础上新增申报儿童的适用范围,如何进行临床评价?
答:持续葡萄糖监测系统(Continuous Glucose Monitoring System,CGMS)目前批准适用范围一般为“产品用于糖尿病成年患者(≥18岁)的组织间液葡萄糖水平的连续或定期监测。产品可提供并存储连续葡萄糖值,供用户跟踪葡萄糖浓度变化的趋势,如葡萄糖水平低于或高于预设值,产品可发出提醒。产品测量结果不作为决定和调整糖尿病患者治疗方案的依据。”国际儿童和青少年糖尿病学会(ISPAD)发布的《2022 ISPAD临床实践指南:儿童、青少年和年轻糖尿病患者的血糖目标和血糖监测》中推荐将儿童、青少年及25岁以下年轻患者纳入持续葡萄糖监测(CGM)控制目标。已上市用于成人的持续葡萄糖检测系统拟增加2-17岁儿童适用范围时,在已有成人适用范围批准的基础上,需通过临床试验路径进行临床评价。
2-17岁儿童可分为2-5岁、6-17岁2个年龄组。其中,6-17岁年龄组入组样本量应保持与成人临床试验要求一致,以静脉血糖值(使用EKF血糖检测仪或Yellow Spring Instrument(YSI)的检测结果)为对照,至少应入组60例提供1200个测量点。2-5岁年龄组儿童如考虑伦理学因素可采用指尖血测量血糖值作为对照,应入组一定样本量的受试者以保证主要评价指标满足要求。
临床试验可采用多中心的自身对照设计,主要评价指标包括:1.与参考值的20/20%的一致性,通过一致率表示;2.测量点落在Clarke误差栅格分析A+B区的比例;3.测量点落在Consensus误差栅格分析A+B区的比例;4.平均绝对相对误差值(MARD%)。
2-5岁、6-17岁各年龄组临床试验结果要求上述四项主要评价指标均应同时达到表1所列标准,方能认为产品性能符合临床应用需要,即按照共同主要终点设置。上述四项主要评价指标中有任何一项或多项未达到所列出的评价标准要求,则不认可产品性能。需注意的是,MARD%评价需先计算每位受试者水平的结果,而不能像其他指标直接计算所有测量点水平的汇总结果。
表1主要评价指标对应的评价标准及原则
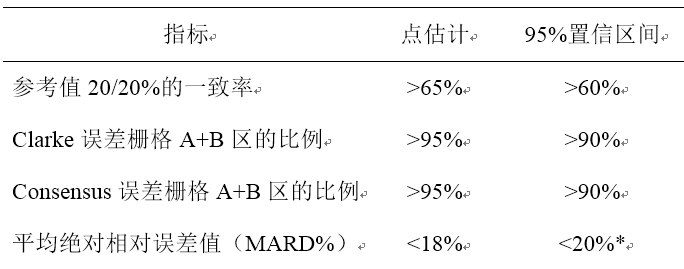
*评价95%置信区间的上限,其余指标评价下限。
上述关于持续葡萄糖监测系统临床试验设计的要求,仅针对传统持续葡萄糖检测系统,即产品用于糖尿病患者的组织间液葡萄糖水平的连续或定期监测,测量结果不作为决定和调整糖尿病患者治疗方案的依据。
临床一部
以下问题回答来自国家药品监督管理局食品药品审核查验中心(CFDI):
问:我司目前的医疗器械产品是经导管瓣膜修复器械,属于III类无源植入类器械,计划在产品拿到注册证后在外地设立新的生产地址。公司现在的生产地址在北京,新的生产地址计划在国内其他省份。问题一是我司这个产品是否可以在国内其他省份设立新的生产地址?问题二是如果可以,是否有指导性文件、操作流程或要求?
答:关于问题一,可以在国内其他省份设立新的生产地址;关于问题二,建议您咨询目标省份的药品监督管理局以便获得更详细的信息。
问:我司有如下医疗器械库房相关问题请教:问题1:如果企业生产许可证上的生产地址有两个,部分产品医疗器械注册证上的生产地址仅有地址1,这部分产品的部分原材料和部分成品(在生产地址1生产的)是否可以放置在地址2? 问题2:企业是否可以租赁部分库房(在医疗器械生产许可证的生产地址范围内的)给其他公司?
答:问题1:根据《医疗器械注册与备案管理办法》第七十九条,“注册人名称和住所、代理人名称和住所等,属于前款规定的需要备案的事项。境内医疗器械生产地址变更的,注册人应当在办理相应的生产许可变更后办理备案。”。问题2:根据《医疗器械生产监督管理办法》第十五条,“生产地址变更或者生产范围增加的,应当向原发证部门申请医疗器械生产许可变更”,涉及生产许可相关问题,需要进一步咨询属地省级药品监督管理部门。
问:我们有一款产品(主机+一次性耗材),一次性耗材与人眼角膜接触,接触时间小于几分之一秒,根据《WS∕T 367-2012 医疗机构消毒技术规范》对于此一次性耗材达到消毒水平即可。请问,生产这样经过消毒的耗材是否一定需在洁净车间生产,如果是,洁净车间的要求按照什么标准/法规执行?
答:对于你公司生产的一次性耗材应当依据《医疗器械分类规则》以及相关分类界定指导原则及《分类目录》等文件规定,综合判定该耗材管理属性及管理类别,相关问题可咨询技术审评部门;并根据该一次性耗材的生产工艺、工作原理、结构组成、使用方法、接触部位及接触时间以及预期目的,确定适宜的消毒/灭菌方法以及生产环境洁净级别管理要求,并开展相应的验证与检测,确保产品安全有效,质量不受环境的影响。
问:如果有一款医疗器械,其中的一个原材料是动物源性的,我们可以外购这个原材料回厂进行组装成成品器械吗?供方具有这款动物源性材料的供体的采购记录、灭活或去病毒等相关验证及生产检验等可追溯性记录。
答:注册和生产动物源性医疗器械应满足《医疗器械生产质量管理规范》及其附录,相关行业标准YY/T0771系列标准,以及《动物源性医疗器械注册技术审查指导原则(2017年修订版)》等相关文件要求。更多内容,建议咨询审评部门。
问:1. 产品介绍:本公司注册产品内镜用粘膜填充剂是一次性使用的无菌医疗器械,同一包装内由羧甲淀粉钠和有输送功能配套使用的螺旋式注射器组成。预期用途为在内镜下粘膜切除之前,对消化道息肉、早期癌或其它病变的粘膜抬举,使其与粘膜下层分离,从而使用其它器械切除病灶。使用方法为羧甲淀粉钠需现场进行配置,按照比例将生理盐水加到装有羧甲淀粉钠的塑料瓶中,摇匀后抽入到螺旋式注射器中,并与市售的粘膜下注射针连接后使用。配套使用的螺旋式注射器主要功能是旋推作用,且只与本产品配套使用,通过旋推力将羧甲淀粉钠溶液输送至粘膜下层此螺旋式注射器是按照产品的特性和临床应用场景进行特殊设计,不同于市售的一次性使用无菌注射器,没有完全按照《GB15810-2019一次性使用无菌注射器》进行开发设计,因此部分性能不同于一次性使用无菌注射器的要求。目前此配套便用的螺旋式注射器是从同省内一家具有生产许可证的厂家采购。 2.问题一:从厂家直接采购配套使用的螺旋式注射器是否需要有产品注册证。 问题二:此配套使用的螺旋式注射器是否需要按照国家食品药品监督管理总局关于生产一次性使用无菌注、输器具2015年第71号中的要求进行管理?
答:确定一个产品是否需要医疗器械注册证,首先要确定该产品是否为医疗器械,该螺旋式注射器若可单独作为二类或者三类医疗器械,就应取得医疗器械注册证,所以应先确定螺旋式注射器的医疗器械属性,若需要进行分类界定应咨询分类界定相关部门。
问:我公司因业务量增大,租赁了一个新场地,拟进行生产许可变更(新增生产地址),在准备申报的过程,通过不动产产权登记查询,发现该地址的产权状态为:已查封,且该地址已被前租户用于公司注册,并且已办理医疗器械生产许可证,医疗器械产品注册,在公司未注销的情况下,我公司是否能用该地址进行生产许可变更申报呢?若该地址在我公司办理生产许可变更申报过程中被查封,请问还能继续办理生产许可变更和后期的产品注册申报吗?
答:医疗器械的生产地址应是合法的能够用于生产医疗器械的场所,不合法的场地/场所是无法作为医疗器械生产地址的。相关产权法律问题建议咨询专业机构和人员。
问:我公司医疗器械属实验室研究阶段,由于实验设备及条件限制,部份实验只能在大学的实验室进行,不知是否可以?如果可以,是否需要一些证明文件?
答:《医疗器械监督管理条例》《医疗器械注册与备案管理办法》以及《医疗器械生产质量管理规范》等法律法规中均未对研制阶段的场地进行限制,但是医疗器械注册人在研制过程也应满足质量管理体系的要求,建立相应的设计开发文件,做好相应的验证、确认工作,保留相应的设计开发记录等。若研发场地或者设施设备为租赁的,应保留相应租赁合同。若部分内容为委托大学或与大学合作完成,也应提供相应的委托合同或合作协议等。
问:如果产品是一种用于非慢性创面护理的复配液体敷料(由A瓶和B瓶组成,A瓶和B瓶都是玻璃瓶,A瓶装的是冻干品,B瓶装的是液体。在使用时,将A瓶和B瓶混合后,用于患处)。 请问如果基于方便患者使用来考虑,可以在该产品的包装中适配一个无菌滴管吗?
答:若增加无菌滴管,属于产品结构组成的变化,属于注册变更内容,建议咨询相关技术审评部门。
问:问题1 本公司业务中包含重组胶原蛋白原料的研发生产和三类医疗器械成品的研发生产,我们在开展三类医疗器械业务的同时,重组胶原蛋白原料也会供给客户用于开发三类医疗器械;客户使用我们的原料进行医疗器械申报时不需要将重组胶原蛋白原料的生产工艺纳入他们的成品工艺中,而是作为供应商管理;我们自身的三类医疗器械生产时是否必须要将原料重组胶原蛋白的生产过程纳入医疗器械生产工艺体系中进行管理,还是可以以类似供应商管理的形式来做? 问题2 本公司核心业务为重组胶原蛋白原料的生产供应,作为核心原物料,客户在申报三类医疗器械时哪些情况会触发对我们的延伸检查?在此想咨询一下,对核心原物料供应商的延伸检查的要点及作为医疗器械核心原材料供应商我们所必须满足的要求有哪些?
答:关于问题一,贵公司自行制备重组胶原蛋白原料,无论从产品风险还是从产品实现过程来看,都应将重组胶原蛋白的生产过程纳入质量体系管理。关于问题二,《医疗器械生产监督管理办法》第四十六条第二款规定:必要时,药品监督管理部门可以对为医疗器械生产活动提供产品或者服务的其他单位和个人开展延伸检查。贵公司作为原材料供应商,应当确保产品符合相关强制性标准要求,对于质量协议、采购合同等文件中约定的产品质量标准和其他条款也应满足。 以上供参考,更多内容建议进一步咨询注册审评部门。
参考资料:

