GB/T 16886《医疗器械生物学评价》系列标准(以下简称16886系列标准)是等同转化ISO 10993系列标准,构成了我国医疗器械生物学评价与试验的完整的标准体系,为国家相关法规提供了技术性支持。一直以来,如何正确理解及实施16886系列标准是医疗器械制造商和医疗器械生物学评价与检验人员所共同关注的问题。
亲爱的小伙伴们!为了帮助大家更全面准确地理解16886系列标准的整体内容,小编精心打磨了《医械检测科普系列》(以下简称《科普系列》)专题,近期将陆续推出GB/T 16886《医疗器械生物学评价》各个部分的要点提炼与重点解读。小编是不是很棒棒,快给小编加鸡腿,文末三连击就更好啦。前期小编已为大家带来《【医械检测科普系列之1】高能干货|探析医疗器械血液相容性评价与试验》和《【医械检测科普系列之2】遗传毒性、致癌性和生殖毒性试验那些事儿......》,反响热烈(感兴趣或者需要复习的小伙伴可以戳上面链接哦)。本期推出的是16886中第5部分体外细胞毒性试验相关内容,包括细胞毒性试验重点内容和影响因素等。
《科普系列》将不断推出医疗器械检测相关知识,大家敬请关注哟!如果您有这方面有感兴趣的的内容,可以在文末留言哦(顺便点个赞和在看),小编一定会尽全力满足哒~~~~
体外细胞毒性试验具有通用性,广泛适用于各种医疗器械和材料的评价。体外细胞毒性试验是一种在离体状态下模拟生物体生长环境,检测医疗器械接触机体组织后所发生的细胞溶解、抑制细胞生长和其他毒性作用的体外试验,几乎也是医械临床应用前的必选项目。与人体接触或植入体内的医疗器械都需要进行细胞毒性试验。通过体外细胞毒性试验,在短时间内较经济、简便地筛选出批量样品的细胞毒性,为动物试验的进行与否提供了先决条件,对新型医疗器械的研制和应用提供了重要保证。
那么体外细胞毒性试验到底讲了什么呢?小编已为您梳理出重点内容:
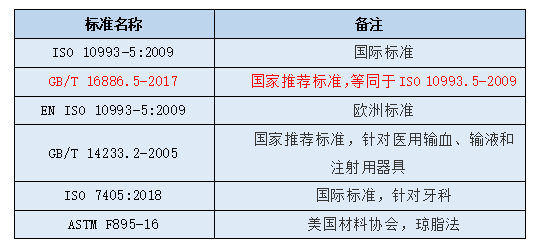
一、体外细胞毒性试验涉及的相关标准
二、决策医疗器械产品开展哪种类型体外细胞毒性试验方法
常用的定性试验包括:直接接触试验、浸提液定性试验、琼脂扩散试验、滤膜扩散试验等;常用的定量试验包括:MTT试验、XTT试验、NRU试验、集落形成试验等。
三、GB/T 16886.5-2017《医疗器械生物学评价第5部分:体外细胞毒性试验》简述

定性分级——分级不大于2通常表明无细胞毒性作用
表1 浸提液细胞毒性形态学定性分级
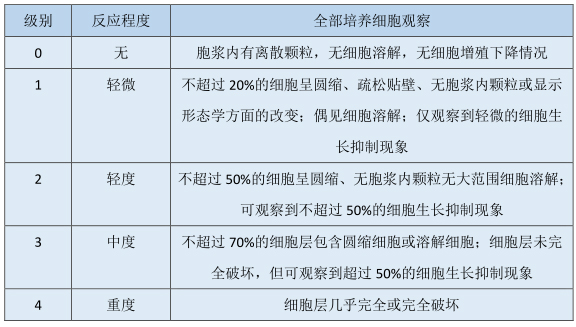
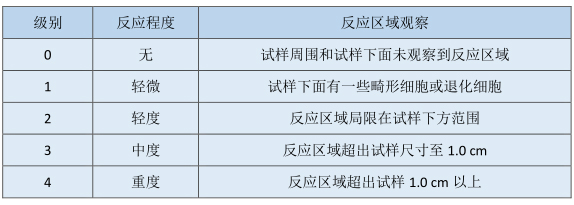
表2 琼脂和滤膜扩散试验以及直接接触试验反应分级
四、影响细胞毒性试验结果的可能因素
较容易出现不合格样品的分类和举例:
【原文来源】GB/T 16886.5-2017
【全文整理】苏州大学卫生与环境技术研究所
【声明】如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注。