现行风险管理对医疗器械的应用指南等标准落后于国际系列标准。近日,全国医疗器械质量管理和通用要求标准化技术委员会归口的2项推荐性行业标准和1项国家标准化指导性技术文件发布征求意见稿。
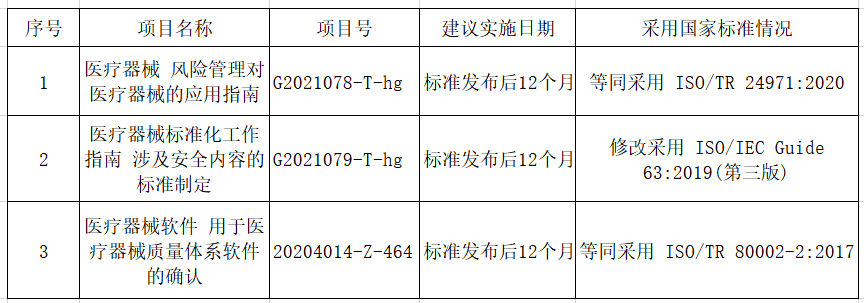
小编已将修订标准的主要技术变化修改梳理如下,敬请查阅:
《医疗器械 风险管理对医疗器械的应用指南》
►增加了“规范性引用文件”(见第2章);
►增加了“术语和定义”(见第3章);
►增加了“风险管理体系通用要求”(见第4章);
►增加了“风险分析”(见第5章);
►增加了“风险评价”(见第6章);
►增加了“风险控制”(见第7章);
►将“综述”更改为“总则”,并更改了相应的技术内容(见8.1); 将“综合剩余风险评价的输入和其他考虑”更改为“输入和其他考量”,并更改了相技术内容(见8.2),增加了“可能的方法”相关的技术内容;
►增加了“风险管理评审”(见第9章)
►更改了“生产和生产后反馈的回路”,增加了“生产和生产后活动”(见第10章,2016年版的第四章);
►增加了“资料性附录A”(见附录A)
►增加了“资料性附录B”(见附录B)
►更改了“制定用于确定可接受性准则的方针”,并将2016年版的有关内容更改后纳入(见附录C,2016年版的第3章);
►更改了“安全信息和剩余风险公示的区别”,并将2016年版的有关内容更改后纳入(见附录D,见2016年版的第5章);
►更改了“产品安全标准和过程标准在风险管理中的作用”,并将2016年版的有关内容更改后纳入(见附录E,见2016年版的第2章);
►增加了“资料性附录F”(见附录F);
►增加了“资料性附录G”(见附录G);
►增加了“资料性附录H”(见附录H)。
《医疗器械标准化工作指南 涉及安全内容的标准制定》征求意见稿》
►增加了第2章“规范性引用文件”,以遵循GB/T 1.1-2020的编写要求(见第2章);
►更改了第3章中所定义的术语,其中多数源于GB/T 20002.4-2015,并基于GHTF指南文件GHTF/SG1/N055:2009和GHTF/SG1/N071:2012更新了“制造商”和“医疗器械”的定义(见第3章,2016年版的第2章);
►增加了第4章,对“安全”、“安全的”、“有效的”和“有效性”等术语的使用提供了指南(见第4章);
►增加了制定涉及安全内容的医疗器械标准的“总则”(见7.1);
►增加了制定涉及安全内容的医疗器械标准的准备工作,包括识别涉及安全内容的新标准或修订标准的需求以及建立制定标准所依据的风险管理框架(7.2.1,7.2.2);
►增加了制定涉及安全内容的医疗器械标准的起草的“总则”和风险管理的迭代过程”(见7.3.1,7.3.2);
►更改了“与医疗器械相关的危险和危险情况”(见7.3.4.3,2016年版的4.5.2);删除了与患者相关的风险(源)和危险情况”(见2016年版的4.5.3); 删除了与使用相关的危险(源)和危险情况”(见2016年版的4.5.4);删除了由于职业原因而暴露于危险情况源和危险情况(见2016年版的4.5.5);
►更改了“风险估计”,(见7.3.5,2016年版的4.7);
►由“标准控制的风险”更改为“识别风险控制”(见7.3.7,2016年版的4.10.1和4.10.2);增加了“产品标准要求和过程标准要求作为适当的风险控制措施”见(7.3.7.4);增加了“在产品标准和过程标准中标记作为风险控制措施”见(7.3.7.4);增加了“包装”(见7.3.7.5);
►增加了“考虑所有已识别的危险/危险情况”(见7.3.11);
►删除了“通过产品标准或过程标准促进ISO 14971的实施”(见2016年版的第5章);
►更改了图1,以更好地说明系列事件如何将危险转化为可能导致危害的危险情况(见图1,2016年版的图1);
►增加了图2,以说明风险管理的迭代过程(见图2);
《医疗器械软件 用于医疗器械质量体系软件的确认》
►为与现有标准协调,将标准名称由《医疗器械软件 用于质量管理体系软件的确认》修改为《医疗器械软件 用于医疗器械体系软件的确认》。
点击下方链接阅读原文:
原文来源:国家药品监督管理局
原文整理:苏州大学卫生与环境技术研究所
声明:如果您认为我们的内容或来源标注与原文不符,请告知我们,我们将与您积极协商解决。谢谢大家的关注!