为保证企业提交的临床前安全性研究资料的真实、准确和完整,以确保临床受试者安全以及保障产品上市后使用者安全。根据《联邦食品、药品和化妆品法》(FFDCA)和《公共卫生服务法》(PHSA),美国食品药品管理局(U.S. Food and Drug Administration,以下简称FDA)要求开展安全性评价研究的非临床实验室应严格遵循GLP准则(即21CFR 58《临床前研究实验室质量管理规范》),并依据该准则对向FDA递交GLP数据的试验机构进行官方审核。
截至2021年6月30日,FDA依照GLP准则(即21CFR 58《临床前研究实验室质量管理规范》)对16家中国试验机构开展了26次的GLP官方检查。其中苏州大学卫生与环境技术研究所是国内唯一一家在医疗器械领域通过FDA官方GLP审核的机构。
点击下方图片可查看大图
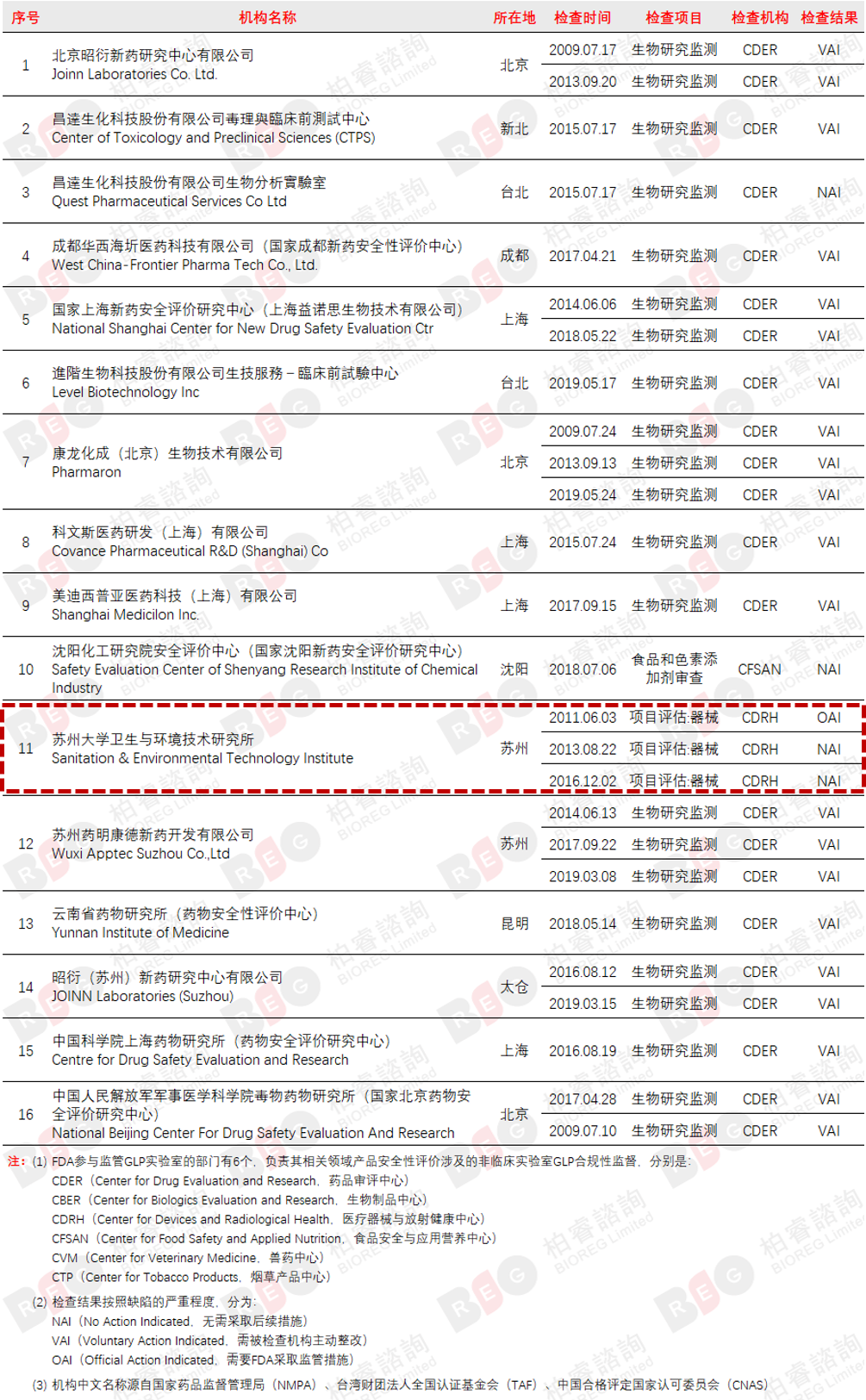
*图片转载自微信平台柏睿聚焦2021.8.9发布的《统计 | FDA/EPA中国实验室GLP检查记录》
FDA负责医疗器械监管的部门是医疗器械和放射健康中心(Center forDevices and Radiological Health, CDRH)。CDRH负责确保美国市场上销售的医疗器械在按照指定用途应用时在合理基础上的安全和有效,同时还负责所有放射性电子产品的安全。CDRH的器械评估办公室(ODE)负责审议所有上市前的申请(PMA)、上市前通告(510(K)/PMN)和上市前批准(PMA)的申请,以及所有未经批准、但将用于临床试验的医疗器械,以确保医疗器械和放射产品的安全、有效和高质量。
CDRH分别于 2011年、2013年、2016年三次对研究所进行了官方GLP飞行检查,其中两次研究所都以NAI(No Action Indicated,无需采取后续措施)的核查结果直接通过,这是FDA对中国试验机构的所有GLP审核中绝无仅有的,代表了FDA对研究所医疗器械检测业务实力的官方认可。
*美国FDA官方网站名单公布截图,
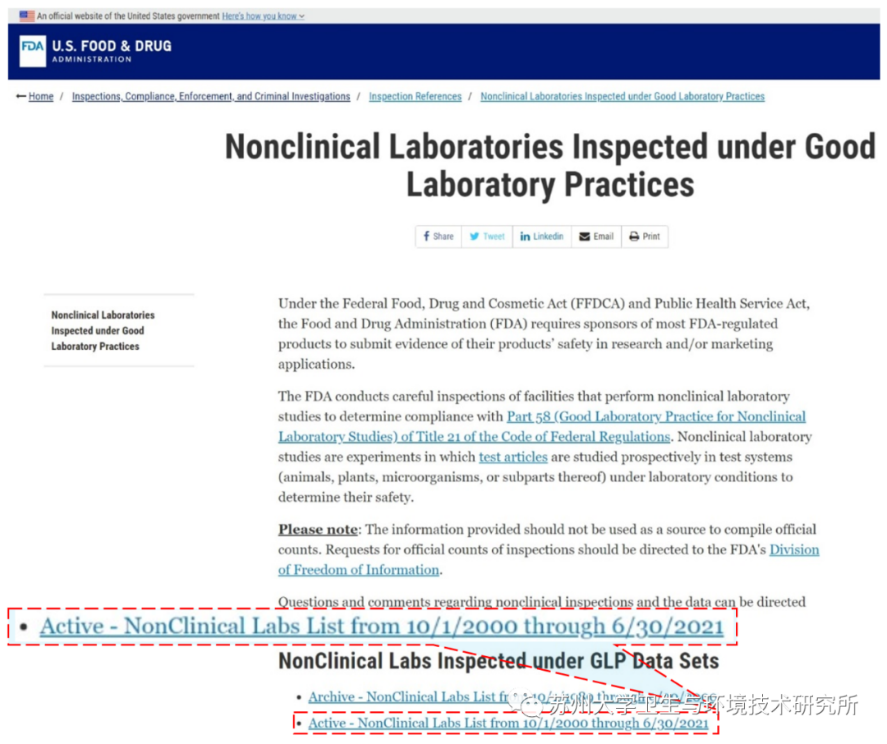
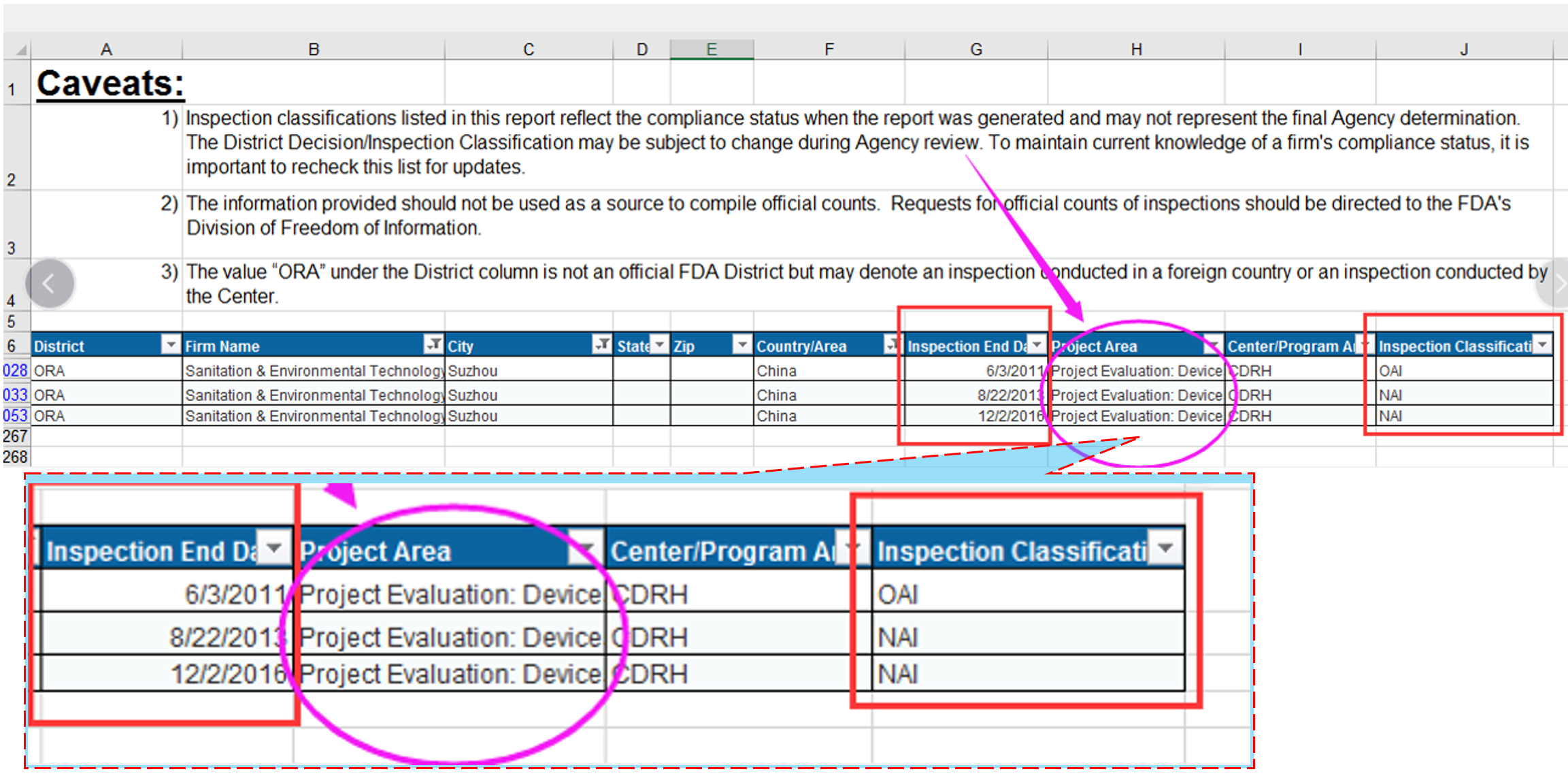
可点击左下阅读原文或扫描下方二维码
跳转至美国FDA官方网站自行查询

随着经济全球化的进程,我国许多医疗器械产品已通过美国FDA认证获准在美国上市,这不但极大促进了中国医疗器械产业的发展,也是对于中国智造的肯定。而苏州大学卫生与环境技术研究所始终秉持学院派的专业严谨,为中国医疗器械走向国际市场而努力护航。
苏州大学卫生与环境技术研究所于2018年通过了由国家认监委组织的医疗器械检验机构资质认定首次评审,以及实验室认可复评审,是最早获得国家CNAS & CMA认可认定的第三方医疗器械检测机构之一,且多年来与美国医疗器械FDA注册机构开展合作,报告被FDA和欧盟直接认可,技术实力获得了国内外客户一致好评,海外客户遍及美、英、德、法、日、韩等三十多个国家。
研究所为医疗器械生产企业提供专业的医疗器械产品和原材料的检测和评价服务,服务能力涵盖生物相容性安全评价及全套检测、微生物试验、包装验证、物理化学性能等,覆盖ISO 10993 (GB/T 16886)、ISO 11137(GB 18280)、ISO 11138(GB 18281)、ISO11737(GB/T 19973)、ISO 11607(GB/T 19633)、GB/T 16292-16294及相关洁净室控制标准。
【相关信息】
与其他OECD成员国不同,美国负责GLP监管的FDA和EPA均不对实验室进行GLP认证,而是对具体试验项目开展GLP符合性监管,仅针对向FDA/EPA递交GLP数据的试验机构进行现场检查和数据审核。
【数据来源】
FDA, Nonclinical Laboratories Inspected under Good Laboratory Practices, 06/30/2021
原文链接:

